Раствор кляйна состав пропорции. Раствор кляйна состав
Таблица 5.

Показатели болевых ощущений в группах Применчание. Таблица 6. Распределение пациентов согласно оценке боли по ВАШ. У 1 пациента из группы, А значение боли от 5,1 до 6 см и у 4 из группы Б значение боли от 7,1 до 9 см показатели боли значительно отличались от таковых у остальных испытуемых.
Вопрос №230 — Зачем нужен раствор Кляйна
На наш взгляд, это объясняется крайне низким порогом болевой чувствительности у этих людей. Мы считаем, что болевые ощущения пациентов при проведении тумесцентной анестезии зависят от количества натрия гидрокарбоната, входящего в состав раствора.
При применении небольших доз натрия гидрокарбоната pH рабочего раствора не достигает щелочных значений, поэтому пациенты чувствуют себя не вполне комфортно. Этим могут объясняться результаты некоторых ранее проведенных исследований, в которых разница болевых ощущений между группами пациентов, получавших буферизованный и небуферизованный растворы, оказалась незначимой [14, 17].
В большинстве ранее проведенных исследований средние показатели боли в группах, где анестезию выполняли с использованием буферизованного раствора, находились в интервале от 1,75 до 2,11 см, что несколько выше среднего значения боли у пациентов группы, А в нашем исследовании.
Возможно, это связано с тем, что непосредственно перед инфильтрацией анестетика под кожу мы обезболивали кожу иглой малого диаметра. Согласно рекомендации Д.

Это связано с тем, что буферная емкость зависит от концентрации раствора, но не прямо пропорциональна ей. Следовательно, для растворов, содержащих разное количество лидокаина, необходимо определять точный объем натрия гидрокарбоната, требуемый для достижения слабощелочных значений pH, близких к физиологическим. Но мы рассчитали объем натрия гидрокарбоната только для того количества лидокаина и адреналина, который мы используем в своей практике.
Если же применять другую концентрацию лидокаина или натрия гидрокарбоната, то возникнет необходимость подбора иного количества натрия гидрокарбоната. Хотя среда раствора в нашем исследовании была слабощелочной и не достигала физиологических значений рН 7,35—7,45 , среднее значение боли существенно не отличалось от данных, полученных в недавно проведенном исследовании, в котором для тумесцентной анестезии при выполнении ЭВЛО использовался буферизованный раствор pH 7,4 [27].
Следовательно, нет необходимости доводить pH тумесцентного раствора до физиологических значений, достаточно того, чтобы этот показатель находился в интервале от 7,1 до 7, В таком случае боль при инфильтрации раствора будет уже обусловлена резко щелочной средой раствора.
Так как порог болевой чувствительности у пациентов сильно различается, то в редких случаях мы все же можем ожидать беспокойное поведение пациентов во время анестезии.
Мы считаем, что у такой, хотя и малочисленной, категории необходимо дополнительно применять седативные средства во время операции. Боль, возникающая при проведении тумесцентной анестезии, уменьшается при увеличении pH раствора. Мы не можем повлиять на буферную емкость натрия гидрокарбоната, но можем корректировать количество буфера. Журналы Флебология 1, Снижение выраженности болевого синдро Снижение выраженности болевого синдрома при проведении тумесцентной анестезии: двойное слепое рандомизированное контролируемое исследование Авторы: О.
Букина Стационар одного дня для больных сердечно-сосудистого профиля Областной клинической больницы им.
Ваш дерматолог
Бабенко, Тамбов, Россия А. Баранов кафедра факультетской хирургии Медицинского института Тамбовского государственного университета им.
Державина, Тамбов, Россия. DOI: Просмотрено: Скачано: Список литературы:.
Коррекция фигуры тумесцентной липосакцией
Surgical management of great saphenous vein varicose veins: a metaanalysis. Randomized clinical trial comparing endovenous laser ablation and stripping of the great saphenous vein with clinical and duplex outcome after 5 years. J Vasc Surg. A systematic review and meta-analysis of randomised controlled trials comparing endovenous ablation and surgical intervention in patients with varicose vein.
6.3 Техника проведения ЭВЛО
ШАГ 1. ПУНКЦИЯ МАГИСТРАЛЬНОЙ ПОДКОЖНОЙ ВЕНЫ И ПРОВЕДЕНИЕ СВЕТОВОДА
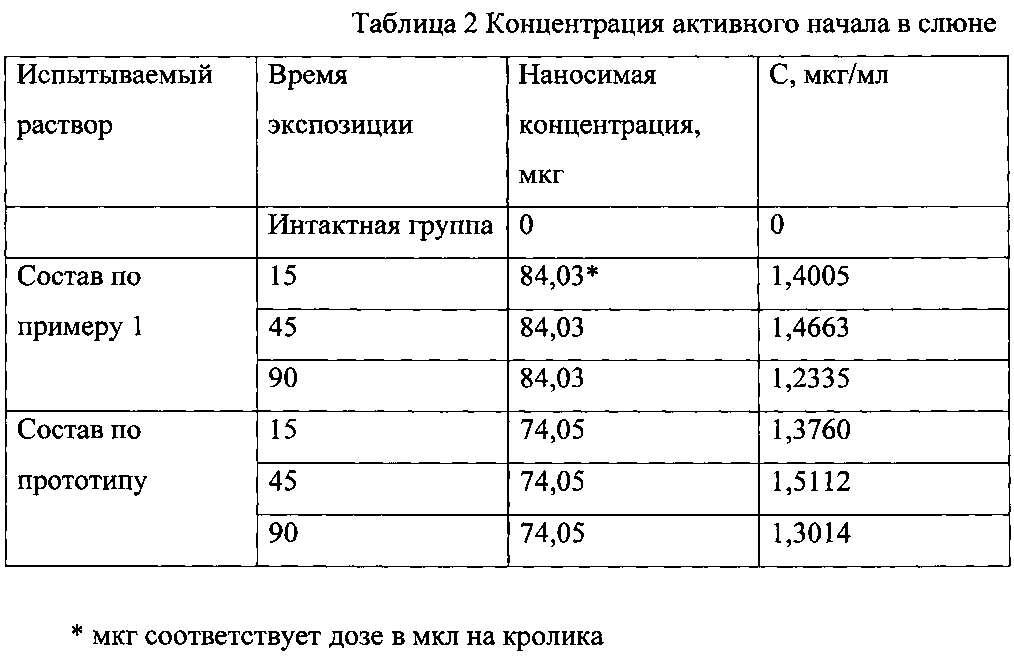
Обработка операционного поля производится стандартно. Наименее травматичным является пункционный способ введения световода в БПВ (МПВ). Для этого возможно использование специальных ангиографических наборов с катетером диаметром 5F. Использование этих наборов обеспечивает несомненное удобство в работе. Ангиографический катетер позволяет пройти большинство изгибов магистральной вены. Отрицательной стороной этих наборов является их достаточно высокая стоимость. Также не исключена вероятность во время ЭВЛО «отжечь» часть катетера в просвете вены с последующей эмболией легочной артерии. С приобретением необходимого опыта, в своей ежедневной работе мы практически отказались от использования катетеров. При определенных практических навыках не представляет труда провести по магистральной подкожной вене только один световод. Для его введения в вену требуется обычный катетер для внутривенных вливаний в периферические вены.
Пунктируется БПВ (МПВ) внутривенным катетером 18 G под контролем ультразвука. Во время пункции помощник устанавливает ультразвуковой датчик параллельно пунктируемой вене, так, чтобы вена на экране монитора была видна в продольном срезе. Это гораздо удобнее поперечного расположения, так как имеется возможность постоянно держать под контролем
Рис. 94. Пункция БПВострие иглы (рис.94, 95).
Рис. 95. Игла внутривенного катетера заведена в ствол БПВ. Отчетливо визуализируется острие иглы.
Рис. 96. Игла извлечена, и в просвете вены остаётся катетер. Он визуализируется в виде структуры, ограниченной двумя параллельными гиперэхогенными полосками.
Далее в просвет вены через катетер вводится световод (рис.97), который под ультразвуковым контролем или по пилотному лучу устанавливается в зоне СФС (СПС).
Во время проведения по просвету вены, световод должен проходить без усилий. В случае возникновения препятствия для световода, его проведение следует прекратить. Далее в поперечном к вене положении ультразвукового датчика визуализируется торец световода, датчик устанавливается параллельно стволу БПВ. В таком положении легко определить место, в которое упёрся конец световода.
Как правило, вена в таком месте делает изгиб. Для преодоления изгиба используется несколько простых приёмов.
1. Если световод упирается в заднюю стенку вены, следует отвести его назад на 2-3 мм, затем слегка надавить на световодом, в 5-6 см дистальнее конца световода. При этом световод дугообразно изгибается, а его рабочая часть приподнимается и позиционируется посредине вены или, при большей силе надавливания, у её передней стенки.
Рис. 97. Введение световода в БПВ через кожу в проекции вены со внутривенный катетер.
2. Если световод упирается в переднюю стенку вены, он также отво- дится назад, а надавливание производят непосредственно ультразвуко- вым датчиком. При этом рабочая часть световода отдавливается к задней стенке и может пройти вдоль неё.
3. Если вена совершает изгиб в медиальную или латеральную стороны, торец световода может повредить боковую стенку вены в месте изгиба. Для предупреждения этого, после ощущения возникшего препятствия, световод отводится назад примерно на 2-3 см. Кожа с подкожной клетчаткой захватывается в складку, в которую должны попасть вена со световодом. Далее складка смещается в сторону изгиба до момента, пока на экране монитора не будет чётко виден выпрямленный участок вены перед торцом световода. Не нужно пытаться одномоментным «рывком» пройти изгиб. Световод следует продвигать вперёд плавно и очень мелкими шагами, буквально по миллиметру. Так можно избежать перфорации вены и преодолеть изгиб.
При безуспешности обойти препятствие тотчас выше него устанавливают ещё один световод.
После преодоления всех препятствий световод плавно продвигают в сторону соустья.
ШАГ 2. ПОЗИЦИОНИРОВАНИЕ РАБОЧЕЙ ЧАСТИ СВЕТОВОДА
После подведения светящейся точки пилотного луча к зоне СФС (рис.98), над этим местом устанавливают датчик и начинают позиционирование рабочей части световода. Используя попеременно поперечное и продольное (по отношению к оси вены) положение датчика ультразвукового сканера, добиваются расположения торца световода superficialis. Сохранение этого верхнего притока многими специалистами расценивается как способ профилактики тромбоза культи БПВ. Тем не менее, в некоторых случаях, возможно введение световода непосредственно в этот приток. При его впадении непосредственно возле остиального клапана, как показано на рисунке 99, возможно «заварить» БПВ вообще без оставления культи. Если так сделать не удается, торец световода позиционируется в 0,5 см от остиального клапана.
Рис. 98. Начало позиционирования рабочей у места впадения v.epigastrica части световода.
Рис. 99. Показан момент подведения световода к соустью.
При работе на МПВ рабочая часть световода позиционируется в 1 см от подколенной вены или вводится в верхний приток МПВ (краниальное продолжение малой подкожной вены – extensio cranialis venae saphenae parvae). Обязателен двойной контроль позиции рабочего торца световода – ультразвуковое изображение и светящийся под кожей пилотный луч (при введении световода в ОБВ свет пилотного луча пропадает). Далее световод фиксируется к коже пластырем.
ШАГ 3. СОЗДАНИЕ ТУМЕСЦЕНТНОЙ АНЕСТЕЗИИ
Следующим шагом создаётся тумесцентная анестезия вокруг ствола БПВ (МПВ). Этот ответственный этап должен проводиться под ультразвуковым контролем. Раствор анестетика вокруг сосуда поглощает тепловую энергию лазерного излучения, предупреждая тем самым повреждение окружающих тканей. Кроме этого, она необходима для адекватного обезболивания. Существуют разные прописи раствора для инфильтрации, мы используем 0,1% раствор лидокаина без примеси адреналина. По опыту работы, адреналин не влияет на качество обезболивания (при правильно выполненной инфильтрации), но создаёт определённые проблемы (тахикардия, повышение артериального давления и др.) у части пациентов. В момент инфильтрации желательно, чтобы остриё иглы практически касалось стенки БПВ (МПВ). В этом случае возможно равномерное распределение раствора в фасциальном футляре БПВ (МПВ). После инфильтрации паравазальных тканей вокруг передней стенки вены иглу продвигают глубже и инфильтрируют ткани вокруг задней стенки сосуда. Таким образом, достигается циркулярная инфильтрация вокруг вены. При правильно созданной тумесцентной анестезии на экране монитора должна быть примерно такая картина, как показано на рисунке 100. Особенно важно правильно создать тумесцентную анестезию в зоне СФС. Она должна защитить расположенные вблизи структуры, прежде всего, бедренную вену от теплового воздействия лазера. Следует убедиться, что раствор в зоне СФС отделяет БПВ от расположенных глубже сосудов. В случае обработки СПС, требования к тумесцентной анестезии аналогичные.
Рис. 100. Правильно созданная тумесцентная анестезия ствола БПВ. Паравазальные ткани инфильтрированы циркулярно. Ярко светящаяся белая точка внутри сосуда – световод.
После того, как оперирующий хирург убедился в адекватности выполненной инфильтрации, следует повторно удостовериться в правильном позиционировании рабочей части световода. Это нужно делать обязательно, так как во время инфильтрации вена сжимается раствором, а рабочий конец световода может сместиться как в дистальном, так и в проксимальном направлении. У нас имеется наблюдение, при котором после создания анестезии рабочая часть оказалась в просвете бедренной вены. Для контроля позиции рабочей части световода очень важно, чтобы при инфильтрации в зоне соустья, производимой на предыдущем этапе, в ткани не попадал воздух из шприца. Загазованность паравазальных тканей создаёт препятствие для ультразвука и может сделать невозможным правильное позиционирование световода. Сразу после окончательного позиционирования рабочей части световода, внутривенный катетер извлекается. Если этого не сделать, сохраняется вероятность забыть сделать это в дальнейшем и пережечь катетер лазером в просвете вены. Описаны случаи миграции отожженной части катетера из БПВ в легочную артерию после проведения ЭВЛО.
ШАГ 4. ПРОВЕДЕНИЕ ЭНДОВЕНОЗНОЙ ЛАЗЕРНОЙ ОБЛИТЕРАЦИИ
Для проведения этого этапа важно правильно выбрать параметры излучения лазера. Здесь и далее описаны параметры для «гемоглобинпоглощаемой» длины волны 1030 нм. Для излучения с длиной волны 1470 нм значения плотности потока энергии уменьшаются в 2,5 раза. Мы применяем мощность излучения от 18 до 25 Вт – при длительности импульса в 900 мс и интервале между импульсами 10 мс (рис.101). Первоначально подаётся один импульс и, окончательно убедившись в правильной позиции световода по выделению газа, подаётся 4-5 импульсов, затем световод отводится на 3 мм назад (шаг), и цикл повторяется. В зоне дуги БПВ, от первой точки до места отхождения наиболее дистального притока, мы создаём плотность потока энергии не менее 200 Дж/см (примерно 10 импульсов на см). Далее от этого места подаётся по 3 импульса на точку, увеличивая длину шага от 3–4 мм (на бедре) до 5-6 мм (область коленного сустава и верхняя треть голени). В месте отхождения наиболее значимых притоков плотность потока энергии должна составлять менее 200 Дж/см. Эти места заранее маркируются на коже, как показано на рис. 98.
Рис. 101. Параметры лазерного излучения при диаметре вены возле соустья 8 мм. Лазерный аппарат «ЛАМИ» отечественного производства с длиной волны 1030 нм и регулируемой мощностью от 0,25 до 25 Вт.
Во время проведения ЭВЛО необходим ультразвуковой контроль движущегося световода. На экране монитора ультразвукового сканера при этом хорошо видно образование газа перед рабочей частью световода (рис.102). Приобретение опыта выполнения ЭВЛО позволило нам постепенно отойти от подсчета количества импульсов и производить контроль над процедурой визуально, по характеру газообразования в просвете вены.
Рис. 102. Момент выполнения лазерной облитера- ции. Отчетливо видны рабочая часть световода, газ и вена, с уплотнёнными гиперэхогенными стенками в участке, обработанном лазером.
Всего на облитерацию БПВ от СФС до нижней трети бедра требуется около 300–350 импульсов. В случае проведения ЭВЛО до верхней трети голени количество импульсов должно составлять 400–450. То есть, плотность потока энергии излучения составляет от 100 до 200 Дж на 1 «погонный» см коагулируемой вены. По окончанию процедуры ЭВЛО, хирург прекращает подачу лазерного излучения на расстоянии 1,5–2 см от места прокола кожи, чтобы не вызвать её ожога. Затем световод извлекается из вены. Далее проводится контроль выполненной процедуры. Ультразвуковой датчик вновь устанавливается в проекции СФС (СПС). Проверяется состояние магистральной глубокой вены. Затем, в поперечном положении к оси коагулированной вены, ультразвуковой датчик проводится в дистальном направлении. Проверяется полнота обработки вены и наличие перфораций. При правильно выполненной процедуре коагулированная вена имеет вид кольца с толстыми стенками. Снаружи от стенок определяется узкий гипоэхогенный ободок – остаток раствора анестетика. В центре вены, как правило, определяются включения газа (рис.103).
Рис. 103. МПВ непосредственно после процедуры ЭВЛО. Определяются резко утолщенные стенки вены и точечный просвет, содержащий газ.
ШАГ 5. НАЛОЖЕНИЕ КОМПРЕСИОННОГО БАНДАЖА
Наложение компрессионного бандажа служит двум целям: уменьшению диаметра и созданию своего рода иммобилизации коагулированной вены. При этом создаются условия максимального «покоя» и закрытие просвета вены происходит без явлений флебита. Компрессионный бандаж состоит из двух частей: пелота, укладываемого вдоль коагулированной вены, и компрессионного трикотажа. В качестве пелота очень хорошо зарекомендовал себя липкий фетр, используемый в качестве подкладочного материала под синтетический гипс. Вначале на кожу наклеиваются полоски липкого бинта, чтобы защитить эпидермис от чрезмерного давления. Если этого не сделать, иногда появляются локальные потёртости с отслойкой эпидермиса и образованием пузырей. Затем клеится фетр или подкладывается заранее подготовленный ватно-марлевый жгут. Сверху наклеивается полоса липкого бинта. Поверх пелота одевается компрессионный чулок 2 класса (рис.104).
Рис.104. Надевание компрессионного чулка 2 класса компрессии VENOTEKS.
ОСОБЕННОСТИ ЭВЛО ПЕРФОРАНТНЫХ ВЕН
Перфорантые вены пунктируются под ультразвуковым контролем (рис.105, 106). Катетер заводится в вену, попадание в которую определяется по изображению на экране монитора ультразвукового сканера и поступлению крови из иглы. После заведения световода в перфорант, вокруг него создаётся тумесцентная анестезия. Процесс облитерации отслеживается по изображению на мониторе. При диаметре перфорантной вены в 5 мм мы используем следующий режим ЭВЛО: мощность 20 Вт, длина импульса 900 мс, интервал между импульсами – 10 мс. Учитывая, что перфорантные вены имеют направление хода перпендикулярное к поверхности кожи, коагулировать их на протяжении в нескольких точках технически сложно, а часто и невозможно. Поэтому нами производится облитерация в одной точке, в которую мы подаём от 15 до 20 импульсов (не менее 300 Дж в 1 точку), стараясь полностью разрушить перфорантную вену в этом месте.
Рис. 105. Пункция перфорантной вены под контролем ультразвука..
Рис.106. Игла введена в перфорантную вену.
УДАЛЕНИЕ ВАРИКОЗНО РАСШИРЕННЫХ ПРИТОКОВ
В настоящее время операция Нарата постепенно теряет своих приверженцев. Этому есть две причины: во-первых, притоки небольшого диаметра могут быть подвергнуты склерооблитерации; во-вторых, её стала вытеснять минифлебэктомия. Минифлебэктомия заключается в выведении наружу и удалении варикозно расширенных притоков с помощью специальных крючков различных модификаций из отдельных проколов кожи длиной 1-2 мм (рис.107). Вены при этом не перевязываются, а проколы не требуют ушивания. Гемостаз достигается эластической компрессией. Спустя несколько месяцев послеоперационные кожные рубцы практически не видны. Минифлебэктомию лучше выполнять после процедуры ЭВЛО. Такая очередность связана с тем, что для успешной облитерации вены в просвете сосуда должна содержаться кровь. При выполнении минифлебэктомии, в просвет БПВ часто попадает воздух, пузыри которого могут привести к неоднородности теплового воздействия на венозную стенку.
Рис.107. Минифлебэктомия под местной анестезией.
Более мелкие притоки, а также ретикулярные вены и телеангиоэктазии устраняются при помощи склеротерапии. Склеротерапия – один из наиболее распространённых методов в Европе, всё большую популярность приобретает у нас в стране. Применение склеротерапии позволяет выполнять большие хирургические вмешательства очень быстро и косметично. В комбинации с ЭВЛО используется склеротерапия по микропенной технологии с ультразвуковым контролем. Склерозант вводится точно в заданные притоки, а ультразвуковой контроль позволяет контролировать его распространение до нужного участка венозной сети.
Виды липосакции, лазерная липосакция, особенности операции, ультразвуковая липосакция
Вакуумная липосакция
Данный вид липосакции включает в себя два способа выведения из тела человека жировых отложений:
Сухая липосакция
Техника выполнения сухой липосакции не предполагает введения в подкожно-жировую клетчатку солевых растворов.
Преимуществом данного метода липосакции является возможность работать с неизмененным контуром тканей, что повышает точность выполнения операции.
Недостаток метода – выраженная кровоточивость тканей, трудоемкость, а также невозможность использования канюль большого диаметра.
Максимальный объем жировой ткани удаляемой при выполнении сухой липосакции составляет не более 2000мл.
Влажная липосакция
Метод влажной липосакции подробно описан G.Hetter и широко используется хирургами.
Техника операции заключается в предварительном насыщении подкожно-жировой клетчатки в зоне липосакции раствором местного анестетика с адреналином. Благодаря гидропрепаровки тканей облегчается экстракция жира, уменьшается травматизация тканей во время операции. Наличие адреналина в растворе приводит к уменьшению диаметра кровеносных сосудов, что в свою очередь, уменьшает кровоточивость тканей.
Техника влажной липосакции позволяет значительно сократить количество крови в аспирате, а значит увеличить объем удаляемой жировой ткани. Метод влажной липосакции широко применяется совместно с аппаратами ультразвуковой, лазерной, радиоволновой липосакции. При выполнении влажной липосакции возможно безопасное удаление до 3000-5000мл жировой эмульсии.
Читать подробнее про данный метод
Гипертьюмесцентная (супервлажная) липосакция
Данный метод липосакции существенно отличается от вышеописанных. Главное отличие заключается в технике инфильтрации раствором подкожной клетчатки в зоне липосакции. В 1987 году Джон Кляйн опубликовал статью «Метод тьюмесценции при выполнении липосакции». В этой статье доктор Кляйн подробно описал технику выполнения больших объемов липосакции при минимальном риске для пациента.
Основная проблема при удалении больших объемов жировой ткани – наличие крови в аспирате, что всегда ограничивает объем липосакции. Джон Кляйн предложил инфильтрировать жировую ткань в зоне операции раствором содержащим адреналин, местный анестетик, карбонатный буфер из расчета минимум 1мл3 раствора на 1мл3 удаляемой жировой ткани. В некоторых случаях необходимо введение 3мл3 раствора на 1мл3 удаляемой жировой ткани. Раствор должен вводиться равномерно на всю толщину жировой ткани. Самый подходящий термин для правильного введения раствора – тугая инфильтрация жировой ткани. В начале 20-го века наш соотечественник хирург А.В. Вишневский описал способ местной инфильтрационной анестезии при помощи послойного введения раствора новокаина в область оперативного вмешательства, назвав его методом “тугого ползущего инфильтрата”. Как говорится, все новое – это хорошо забытое старое.
Гипертьюмесцентная липосакция наименее травматичная из всех типов липосакций, позволяет убрать большой объем жировой ткани благодаря минимальной примеси крови в аспирате. Это достигается за счет следующих механизмов:
- Гидропрепаровка тканей. За счет плотной инфильтрации тканей раствором межклеточные сзязи становятся менее прочными, как бы растягиваются. Жировые клетки со всех сторон окружены жидкостью, что очень важно для последующей их вакуум экстракции.
- Сдавление вводимым раствором кровеносных и лимфатических сосудов. Быстрое введение большого количества жидкости в подкожную клетчатку приводит к сдавлению кровеносных и лимфатических сосудов и, как следствие, сужению их диаметра. В дальнейшем при выполнении липосакции кровоточивость сосудов значительно уменьшается. Кроме того, вводимый раствор как бы выдавливает кровь и лимфу из сосудов.
- Жировые клетки после тугой инфильтрации находятся в растворе во взвешенном состоянии, что существенно облегчает их механическое удаление.
- Воздействие адреналина на кровеносные и лимфатические сосуды. Под воздействием адреналина входящим в раствор Кляйна, кровеносные сосуды сужаются, что также способствует снижению кровопотери во время выполнения липосакции.
- При выполнении гипертьюмесцентной (супервлажной) липосакции возможно удаление до 10000мл жировой эмульсии.
Ультразвуковая липосакция
Ультразвуковая липосакция выполняется с помощью аппаратов, генерирующих ультразвуковые импульсы, которые разрушают жировые клетки.
 На рисунке представлен аппарат Sonoca Lipo немецкого производителя Soring.
На рисунке представлен аппарат Sonoca Lipo немецкого производителя Soring.
Ультразвуковой генератор управляется микропроцессором и может генерировать ультразвуковые волны, которые преобразуются в механические колебания. Необходимое значение мощности ультразвука хирург может устанавливать на панели управления аппаратом.
Техника выполнения ультразвуковой липосакции во многом похожа на технику гипертьюмесцентной липосакции. Операция начинается с тщательной инфильтрации подкожно-жировой клетчатки раствором Кляйна.
Затем выполняется основной этап липосакции с помощью канюль имеющих на конце ультразвуковой диссектор. Удаление жировой эмульсии осуществляется с помощью вакуум аспирации. Завершается операция наложением стерильных повязок и одеванием компрессионного белья.
Читать подробнее про данный метод
Лазерная липосакция
 Лазерная липосакция метод основанный на воздействие излучения лазера на жировую ткань. Под воздействием излучения лазера в подкожной жировой клетчатке происходит разрушение клеточной мембраны жировых клеток и глубокий прогрев тканей, что уменьшает кровотечение, также стимулирует образование нового коллагена.
Лазерная липосакция метод основанный на воздействие излучения лазера на жировую ткань. Под воздействием излучения лазера в подкожной жировой клетчатке происходит разрушение клеточной мембраны жировых клеток и глубокий прогрев тканей, что уменьшает кровотечение, также стимулирует образование нового коллагена.
На рисунке представлен аппарат для лазерной липосакции Smartlipo итальянского производителя DEKA.
Лазерная липосакция начинается с инфильтрации подкожной клетчатки раствором Кляйна. Затем выполняется основной этап операции с помощью канюли на конце которой находится световод излучающий лазерный луч. Удаление жировой ткани осуществляется с помощью вакуум аспирации. Операция завершается наложением стерильных повязок и одеванием компрессионного белья.
Читать подробнее про данный метод
Водоструйная липосакция
Метод аппаратной липосакции основанный на принципе работы водоструйного отсоса. Принцип работы аппарата заключается в подаче под давлением воды в подкожную клетчатку, которая является диссектором для жировой ткани, с последующим удалением жировой эмульсии с помощью вакуумного отсоса.
 | 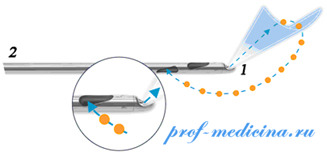 |
Вода подается в ткани с помощью специальной канюли под давлением, что позволяет селективно воздействовать на жировые клетки, сохраняя целостность более плотных структур, таких как кровеносные сосуды и нервы. Фрагментированный жир удаляется с помощью вакуумного отсоса. Операция заканчивается наложением швов на проколы и одеванием компрессионного белья.
Читать подробнее про данный метод
Радиоволновая (радиочастотная) липосакция
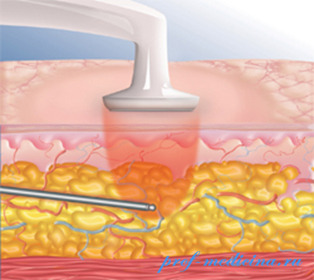
Попытки хирургов и инженеров усовершенствовать методы липосакции привели к разработке нового аппарата (BodyTite) для удаления жировой ткани в основу которого был положен принцип обработки тканей с помощью радиоволнового излучения. Аппарат для радиочастотной липосакции представляет собой высокотехнологичный инструмент, в основе которого лечит генератор высокой частоты управляемый компьютером. Аппарат работает от электросети, с помощью ВЧ-генератора переменный электроток преобразуется в ток высокой частоты.
 |  Между электродами создается электромагнитное поле высокой частоты, которое приводит к нагреванию тканей, что ведет к сокращению кровеносных сосудов, стимулирует образование коллагена и эластина вдерме. Между электродами создается электромагнитное поле высокой частоты, которое приводит к нагреванию тканей, что ведет к сокращению кровеносных сосудов, стимулирует образование коллагена и эластина вдерме. |
Между электродами создается электромагнитное поле высокой частоты, которое приводит к нагреванию тканей, что ведет к сокращению кровеносных сосудов, стимулирует образование коллагена и эластина вдерме.
Операция радиоволновой (радиочастотной) липосакции начинается с инфильтрации подкожной клетчатки раствором Кляйна. Затем выполняется основной этап операции. После удаления жировой эмульсии на проколы накладываются швы и асептические повязки. Операция завершается одеванием специального компрессионного трикотажа.
раствор клейна — это… Что такое раствор клейна?
- раствор клейна
раствор клейна
—
[Англо-русский геммологический словарь. Красноярск, КрасБерри. 2007.]Тематики
- геммология и ювелирное производство
Справочник технического переводчика. – Интент. 2009-2013.
- раствор кислоты
- таймер
Смотреть что такое «раствор клейна» в других словарях:
КЛЕЙНА — НИШЙНЫ ФОРМУЛА — выражение для дифференц. сечения ds рассеяния фотона на электроне (см. Комптона эффект). В лаб. системе координат где частоты падающего и рассеянного фотона, элемент телесного угла для рассеянного фотона, угол рассеяния, параметр r0 = e … Физическая энциклопедия
РОДЫ — РОДЫ. Содержание: I. Определение понятия. Изменения в организме во время Р. Причины наступления Р………………… 109 II. Клиническое течение физиологических Р. . 132 Ш. Механика Р. …………….. 152 IV. Ведение Р……………… 169 V … Большая медицинская энциклопедия
Мир будущего в «Футураме» — Действие мультипликационного сериала Футурама в основном происходит в отдалённом будущем. В первом эпизоде сериала главный герой, Фрай, попадает в 3000 год, в город Нью Нью Йорк, построенный на месте современного Нью Йорка. Содержание 1 Политика… … Википедия
СССР. Естественные науки — Математика Научные исследования в области математики начали проводиться в России с 18 в., когда членами Петербургской АН стали Л. Эйлер, Д. Бернулли и другие западноевропейские учёные. По замыслу Петра I академики иностранцы… … Большая советская энциклопедия
Бактерии — под именем бактерий в науке известны мельчайшие, микроскопической величины организмы, принадлежащие к растительному царству. По своей организации, по своим морфологическим особенностям, Б. ближе всего стоят к так называемым циановым или… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Мезаденит — I Мезаденит (анат. mes [enterium] брыжейка + греч. aden железа + itis; синоним: мезентеральный лимфаденит, мезентерит) воспаление лимфатических узлов брыжейки кишечника. Мезаденит подразделяют на неспецифический (простой и гнойный), туберкулезный … Медицинская энциклопедия
Энцефалиты — Энцефалит Вирус энцефалита: внутри вирусные гены, снаружи шипики для сцепления с клетками жертвами. МКБ 10 A83. A … Википедия
Тумесцентная липосакция | Пластическая хирургия Dr.Shihirman
Изобретение тумесцентной липосакции стало настоящей революцией в пластической медицине. Впервые данная процедура была проведена в 1985 году. Изобретена она была доктором-дерматологом по фамилии Кляйн. Сейчас по его методу проводится большинство операций по удалению жира в мире. И это не удивительно, ведь разработанная в 1985 году методика сочетает в себе такие качества как высокая эффективность и малая по сравнению с классической механической липосакцией травматичность.
Особенности метода
Суть данной методики заключается в использовании специальных препаратов, которые вводятся в жировую ткань и способствуют её более безопасному и быстрому выведению из организма. Состав, разработанный доктором Кляйном, состоит из трёх препаратов — лидокаина, адреналина и физиологического раствора. Он вводится в жировую ткань и позволяет сократить кровопотери, а также призван обезболить зону воздействия. Обратите внимание на то, что в ходе такой процедуры могут вводиться значительные дозы рабочего раствора. Обычно они равны предполагаемому количеству отсасываемого жира. Это необходимо для того, чтобы жировая ткань превратилась в жидкую эмульсию, которая будет удаляться с помощью специальных канюль. Причём канюли эти намного тоньше, чем при проведении липосакции классическим вакуумным способом. Благодаря тому, что жир растворяется под воздействием раствора Кляйна, сама процедура проходит с меньшими повреждениями сосудов и других подкожных тканей. При этом она позволяет достичь ощутимого эффекта удаления жира.
Преимущества методики
Использование тонких канюлей и невысокая степень повреждения кровеносных сосудов делают данную процедуру менее травматичной, чем обычная липосакция. В некоторых случаях даже возможно проведение удаления жира по методу доктора Кляйна без общей анестезии. Обезболивание при этом осуществляется непосредственно в месте вмешательства, а также вводятся седативные препараты внутривенно. В результате человек находится в сознании на протяжении всей процедуры и не испытывает никаких негативных ощущений. Благодаря отсутствию общей анестезии значительно снижается риск развития осложнений в ходе операции.
Так как липосакция с применением раствора Кляйна проводится с применением канюль малого диаметра, на коже пациента остаются лишь незначительные разрезы, которые быстро заживают. Это положительно сказывается не только на эстетической привлекательности человека, прошедшего через операцию по удалению жира. Низкая степень инвазивности обусловила и короткий срок восстановления после процедуры. Как правило, операционный стол после проведения тумесцентной липосакции пациенты покидают самостоятельно, и уже через пару часов могут покинуть клинику. Ограничения по движению и физическим нагрузкам накладываются на пациента не более чем на четыре дня, после чего он может вернуться к своей обычной жизни.
Несмотря на очевидные преимущества, данный метод связан и с определёнными трудностями. Проблемы возникают в том случае, если разрушенные жировые волокна не были полностью удалены из-под кожи, в результате чего на теле образуются непривлекательные углубления.
Снижение выраженности болевого синдрома при проведении тумесцентной анестезии: двойное слепое рандомизированное контролируемое исследование — Флебология — 2017-01
Эндовенозная лазерная (ЭВЛО) и радиочастотная облитерация (РЧО) являются наиболее популярными методами лечения варикозной болезни во многих странах. По данным значительного количества исследований, эти методы так же эффективны, как и открытая хирургия, и имеют ряд преимуществ по сравнению с последней в раннем послеоперационном периоде: меньше гематом, ниже частота инфекционных осложнений, ниже уровень послеоперационной боли и меньше период нетрудоспособности [1—13]. Кроме того, вмешательства выполняют под местной (тумесцентной) анестезией, что дает возможность проводить их в амбулаторных условиях. Вместе с тем, несмотря на очевидные преимущества тумесцентной анестезии, ей свойственны и определенные недостатки. Одним из наиболее существенных является дискомфорт и болевые ощущения, связанные с инфильтрацией анестетика под кожу.
Проблема наличия боли в момент проведения инфильтрационной анестезии привлекла внимание клиницистов в начале 90-х годов XX века, задолго до того как появились эндовенозные термические методы хирургического лечения варикозной болезни. В результате ряда экспериментальных исследований, проведенных с участием здоровых добровольцев, показано, что выраженность болевых ощущений зависит от температуры и pH раствора [14—19]. Подогрев раствора до 37 °C, а также увеличение его pH более 7,1 обеспечивали менее болезненные ощущения при введении анестетика. Позже эти данные были подтверждены в клинической практике [20—25].
Физиологический раствор имеет различный pH, который колеблется в широком диапазоне, а именно от 4,5 до 7,2. При добавлении лидокаина и адреналина среда раствора становится еще более кислой, что является причиной болезненных ощущений при проведении тумесцентной анестезии. Для смещения pH раствора в щелочную сторону принято использовать раствор натрия бикарбоната (гидрокарбоната). Буферная емкость раствора натрия бикарбоната зависит от его концентрации. Чтобы создать щелочную среду раствора для тумесцентной анестезии, необходимо 12,5 мл 8,4% раствора натрия бикарбоната на 1000 мл 0,05% раствора лидокаина с адреналином, как это следует из классической рекомендации Д. Кляйна [26]. Однако для тумесцентной анестезии при термических методах лечения варикозной болезни чаще всего используют лидокаин в концентрации более 0,05%. Следовательно, для буферизации может потребоваться большее количество 8,4% раствора натрия бикарбоната. Кроме того, возможно применение натрия бикарбоната другой концентрации. Буферная емкость 4 и 5% растворов натрия гидрокарбоната, которые преимущественно доступны в нашей стране, значительно ниже, чем у 8,4% раствора, поэтому для достижения щелочных значений pH необходим больший объем натрия гидрокарбоната. Таким образом, для создания комфортных условий проведения анестезии при ЭВЛО и РЧО требуется несколько иной состав раствора анестетика, чем тот, что был предложен Д. Кляйном.
Цель настоящей работы — определение оптимального количества 4% натрия гидрокарбоната, которое необходимо добавить в раствор для тумесцентной анестезии с тем, чтобы минимизировать болевые ощущения при выполнении анестезии.
Проведено рандомизированное двойное слепое контролируемое исследование. Для проведения исследования было получено разрешение локального этического комитета. В исследование включены все пациенты с варикозной болезнью классов С2—С5 (возраст пациентов от 20 до 60 лет), которым планировалось проведение ЭВЛО в бассейне большой, малой или передней добавочной подкожных вен в период с 1.11.15 по 19.02.16.
После получения информированного согласия пациентов случайным образом разделили на две группы с помощью метода конвертов. В группу, А вошли 34 больных, которым планировали выполнить ЭВЛО и минифлебэктомию под тумесцентной анестезией 0,08% раствором лидокаина pH 7,1, содержащим повышенный объем натрия гидрокарбоната. В группе Б (40 пациентов) для тумесцентной анестезии предполагалось использовать раствор pH 6,63, содержащий натрия гидрокарбонат в том количестве, которое было получено при пересчете концентрации 8,4% раствора на 4%. Для приготовления тумесцентного раствора в обеих группах использовали физиологический раствор pH 6,85, в качестве буфера — 4% раствор натрия гидрокарбоната pH 7,87. Значения pH растворов измеряли с помощью анализатора газов крови ABL80 FLEX.
На предварительном этапе проведен расчет необходимого количества 4% натрия гидрокарбоната для создания требуемого рН раствора. В ходе лабораторных измерений убедились в том, что среда раствора зависит от концентрации лидокаина, концентрации натрия гидрокарбоната и количества натрия гидрокарбоната. Установлено, что при использовании 0,08% раствора лидокаина для достижения щелочных значений pH нам необходимо 142,8 мл 4% натрия гидрокарбоната (табл. 1). Таким образом, для приготовления раствора, А на 1000 мл 0,9% раствора натрия хлорида потребовалось 800 мг лидокаина, 0,4 мл адреналина, 142,8 мл 4% раствора натрия гидрокарбоната. Для получения раствора Б на 1000 мл 0,9% раствора натрия хлорида — 800 мг лидокаина, 0,4 мл адреналина, 25,6 мл 4% раствора натрия гидрокарбоната (табл. 2).
Таблица 1. Зависимость среды раствора от концентрации лидокаина и натрия гидрокарбоната и количества натрия гидрокарбоната
Таблица 2. Состав и pH раствора для тумесцентной анестезии
Все операции и анестезия были выполнены одним хирургом без ассистента. Раствор готовила операционная сестра непосредственно перед вмешательством. Хирург, выполнявший операцию, не знал, какой раствор он использует. После позиционирования световода в сафенофеморальном соустье проводили точечную анестезию кожи в проекции ствола большой подкожной вены иглой 30 G. Это необходимо, чтобы снизить болевые ощущения при прокалывании кожи иглой большего диаметра. Тумесцентную анестезию выполняли вручную, без применения нагнетателя раствора (помпы). В 65 случаях вмешательство выполнили в бассейне большой подкожной вены, в 5 случаях — в бассейне малой подкожной вены, в 4 — в бассейне передней добавочной подкожной вены.
Критерием оценки служил уровень боли во время проведения тумесцентной анестезии различными вариантами растворов. Непосредственно после операции пациенту, который также не знал, каким именно раствором проводили анестезию, предлагали с помощью ВАШ оценить уровень болевых ощущений, испытанных во время введения анестетика. ВАШ для оценки уровня боли сразу после операции пациентам предлагал сотрудник клиники, не осведомленный, каким раствором выполняли анестезию.
Обработка данных исследования была выполнена с использованием общедоступных онлайн-калькуляторов. Для сравнения относительных показателей использовали критерий χ2. Для сравнения количественных показателей использовали параметрические (среднее, стандартное отклонение, критерий Стьюдента) и непараметрические (медиана, интерквартильный размах, U-критерий Манна—Уитни) методы.
Средний возраст пациентов группы, А составил 44,8±12,2 года, группы Б — 45,1±9,5 года. Соотношение женщин и мужчин в группе, А было 25:9, в группе Б — 33:7. Группы пациентов оказались сопоставимы по возрасту, полу, клиническому классу болезни (табл. 3).
Таблица 3. Сравнительная характеристика групп пациентов Примечание.* — p>0,05 (непарный t-критерий или критерий χ²).
Длительность операции в группе, А составила от 30 мин до 2 ч 30 мин (в среднем 1,3±0,47 ч), в группе Б — от 30 мин до 2 ч 15 мин (в среднем 1,4±0,53 ч). Объем введенного для анестезии раствора колебался в группе, А от 100 до 600 мл (в среднем 438,2±153,7 мл), в группе Б — от 100 до 800 мл (в среднем 432,5±172,6 мл). По длительности операции и объему введенного раствора группы были сопоставимы (табл. 4).
Таблица 4.Сравнительная характеристика длительности операции и объема раствора в группах Примечание. * — непарный t-критерий.
Среднее значение боли (интерквартильный размах) по ВАШ в группе, А составило 0,65 (0,2—1,38), в группе Б — 1,65 (0,87—3,5), p<0,01 (рис. 1).
Рис. 1. Показатели боли в группах.
В группе, А 5 пациентов сообщили о полном отсутствии болевых ощущений. В группе Б ни один из больных не сообщил об отсутствии боли при введении анестетика. Кроме того, выраженные болевые ощущения (более 5 см по ВАШ) отмечены у 6 пациентов в группе Б и только у 1 в группе А, однако различие оказалось статистически незначимым (табл. 5). Максимальное значение боли в группе, А было 5,9 см, в группе Б — 8,7 см. В группе, А основная часть пациентов отмечала уровень боли в интервале от 0 до 1 см. В группе Б в этом интервале оказалось значительно меньше оценок и распределение было более равномерным в интервале от 1 до 9 (табл. 6, рис. 2).
Таблица 5.Показатели болевых ощущений в группах Применчание. * — U-критерий Манна—Уитни, ** — критерий χ2.
Таблица 6.Распределение пациентов согласно оценке боли по ВАШ
Рис. 2. Распределение пациентов согласно оценке боли по ВАШ.
У 1 пациента из группы, А (значение боли от 5,1 до 6 см) и у 4 из группы Б (значение боли от 7,1 до 9 см) показатели боли значительно отличались от таковых у остальных испытуемых. На наш взгляд, это объясняется крайне низким порогом болевой чувствительности у этих людей.
Мы считаем, что болевые ощущения пациентов при проведении тумесцентной анестезии зависят от количества натрия гидрокарбоната, входящего в состав раствора. При применении небольших доз натрия гидрокарбоната pH рабочего раствора не достигает щелочных значений, поэтому пациенты чувствуют себя не вполне комфортно. Этим могут объясняться результаты некоторых ранее проведенных исследований, в которых разница болевых ощущений между группами пациентов, получавших буферизованный и небуферизованный растворы, оказалась незначимой [14, 17].
В большинстве ранее проведенных исследований средние показатели боли в группах, где анестезию выполняли с использованием буферизованного раствора, находились в интервале от 1,75 до 2,11 см, что несколько выше среднего значения боли у пациентов группы, А в нашем исследовании. Возможно, это связано с тем, что непосредственно перед инфильтрацией анестетика под кожу мы обезболивали кожу иглой малого диаметра.
В разных странах налажено производство раствора натрия бикарбоната (гидрокарбоната) различной концентрации: 4, 5, 7, 8,4 и 10%. Согласно рекомендации Д. Кляйна, при разведении 12,5 мл 8,4% натрия гидрокарбоната в 1000 мл физиологического раствора получается 0,1% раствор. Если для буферизации использовать 4% натрия гидрокарбонат, сделать пересчет концентрации растворов и изготовить также 0,1% раствор, то мы не достигнем желаемых щелочных значений pH. Это связано с тем, что буферная емкость зависит от концентрации раствора, но не прямо пропорциональна ей.
Если применять к тому же лидокаин в концентрации более 0,05%, к примеру 0,08%, то pH будет еще ниже. Следовательно, для растворов, содержащих разное количество лидокаина, необходимо определять точный объем натрия гидрокарбоната, требуемый для достижения слабощелочных значений pH, близких к физиологическим. Мы нашли оптимальный объем 4% раствора натрия гидрокарбоната, который способен довести pH 0,08% раствора лидокаина и адреналина до 7,1 и значительно облегчить болевые ощущения во время анестезии. Но мы рассчитали объем натрия гидрокарбоната только для того количества лидокаина и адреналина, который мы используем в своей практике. Если же применять другую концентрацию лидокаина или натрия гидрокарбоната, то возникнет необходимость подбора иного количества натрия гидрокарбоната.
Хотя среда раствора в нашем исследовании была слабощелочной и не достигала физиологических значений (рН 7,35—7,45), среднее значение боли существенно не отличалось от данных, полученных в недавно проведенном исследовании, в котором для тумесцентной анестезии при выполнении ЭВЛО использовался буферизованный раствор pH 7,4 [27]. Следовательно, нет необходимости доводить pH тумесцентного раствора до физиологических значений, достаточно того, чтобы этот показатель находился в интервале от 7,1 до 7,45. Кроме того, среда готовых растворов лидокаина, адреналина и 0,9% натрий хлорида может значительно колебаться и быть более щелочной, чем та, что использовалась в исследованиях, тогда высока вероятность приготовить раствор pH 7,5 и более, как это показано в вышеупомянутом исследовании [27]. В таком случае боль при инфильтрации раствора будет уже обусловлена резко щелочной средой раствора.
Так как порог болевой чувствительности у пациентов сильно различается, то в редких случаях мы все же можем ожидать беспокойное поведение пациентов во время анестезии. Мы считаем, что у такой, хотя и малочисленной, категории необходимо дополнительно применять седативные средства во время операции.
Боль, возникающая при проведении тумесцентной анестезии, уменьшается при увеличении pH раствора. Мы не можем повлиять на буферную емкость натрия гидрокарбоната, но можем корректировать количество буфера. Если для буферизации использовать 4% раствор натрия гидрокарбоната, то для достижения комфортных условий проведения анестезии объем буфера должен составлять 142,8 мл на 1000 мл 0,08% раствора лидокаина с адреналином.
Конфликт интересов: авторы сообщают об отсутствии конфликта интересов.
Участие авторов:
Концепция и дизайн исследования — О.Б.
Сбор и обработка материтала — О.Б., А.Б.
Написание теста — О.Б., А.Б.
Редактирование — О.Б.



